Senyawa hidrokarbon merupakan senyawa kimia yang terdiri dari unsur hidrogen (H) dan karbon (C). Kombinasi unsur ini membentuk berbagai jenis senyawa dengan beragam sifat dan struktur. Hidrokarbon merupakan dasar dari kimia organik, yang mencakup berbagai macam senyawa yang ada di alam maupun yang dapat disintesis.
Struktur dasar hidrokarbon merupakan rantai karbon yang dapat bercabang maupun tidak bercabang. Rantai karbon ini bisa membentuk ikatan dengan atom hidrogen dan juga dapat membentuk ikatan ganda maupun ikatan rangkap dengan atom karbon lainnya. Terdapat beberapa jenis hidrokarbon utama, antara lain alkana, alkena, alkuna, dan sikloalkana.
Alkana merupakan jenis hidrokarbon yang mempunyai ikatan tunggal antara atom karbon. Contoh alkana yang umum merupakan metana (CH4), etana (C2H6), dan propana (C3H8). Alkena mempunyai satu maupun lebih ikatan rangkap antara atom karbon. Contoh alkena meliputi etena (C2H4) dan propena (C3H6). Sementara itu, alkuna mempunyai satu maupun lebih ikatan rangkap tiga antara atom karbon. Contoh alkuna merupakan etuna (C2H2) dan propuna (C3H4).
Sikloalkana merupakan hidrokarbon yang mempunyai cincin karbon tertutup. Contoh sikloalkana termasuk sikloheksana (C6H12) dan siklopentana (C5H10). Selain itu, hidrokarbon aromatik juga termasuk dalam kategori senyawa hidrokarbon. Senyawa aromatik paling terkenal merupakan benzena (C6H6) yang mempunyai struktur cincin karbon yang stabil dan khas.
Hidrokarbon mempunyai berbagai macam kegunaan dan aplikasi. Banyak hidrokarbon yang digunakan sebagai bahan bakar, seperti bensin, minyak diesel, dan gas alam. Selain itu, hidrokarbon juga digunakan dalam industri kimia untuk memproduksi berbagai senyawa organik, termasuk plastik, serat sintetis, dan obat-obatan.
Namun, penting untuk diingat bahwa beberapa hidrokarbon dapat menjadi polutan lingkungan jika tidak diolah maupun dibuang dengan benar. Misalnya, hidrokarbon aromatik yang terdapat dalam bahan bakar fosil dapat berkontribusi terhadap polusi udara dan efek rumah kaca.
Secara keseluruhan, senyawa hidrokarbon merupakan kelompok senyawa kimia yang sangat penting dan beragam. Mereka mempunyai peran sentral dalam kimia organik dan mempunyai dampak signifikan dalam berbagai aspek kehidupan manusia, mulai dari energi hingga industri dan lingkungan.
Jenis Senyawa Hidrokarbon
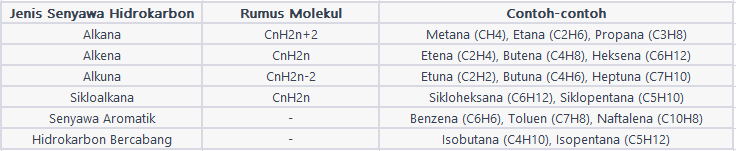
Jenis-jenis senyawa hidrokarbon dapat dikelompokkan berdasarkan struktur dan ikatan antara atom karbon dalam molekulnya. Berikut merupakan beberapa jenis senyawa yang umum:
- Alkana: Alkana merupakan senyawa hidrokarbon jenuh yang hanya mempunyai ikatan tunggal antara atom karbon dalam molekulnya. Contoh alkana termasuk metana (CH4), etana (C2H6), propana (C3H8), dan butana (C4H10). Alkana mempunyai rantai lurus maupun bercabang dari atom karbon.
- Alkena: Alkena merupakan senyawa hidrokarbon tak jenuh yang mempunyai setidaknya satu ikatan rangkap antara atom karbon dalam molekulnya. Contoh alkena termasuk etena (C2H4), propena (C3H6), dan butena (C4H8). Alkena mempunyai rantai karbon dengan satu maupun lebih ikatan rangkap ganda.
- Alkuna: Alkuna merupakan senyawa hidrokarbon tak jenuh yang mempunyai setidaknya satu ikatan rangkap-tunggal antara atom karbon dalam molekulnya. Contoh alkuna termasuk etuna (C2H2), propuna (C3H4), dan butuna (C4H6). Alkuna mempunyai rantai karbon dengan satu maupun lebih ikatan rangkap-tunggal.
- Senyawa Aromatik: senyawa hidrokarbon aromatik mempunyai cincin karbon stabil dengan ikatan rangkap resonansi. Contoh senyawa hidrokarbon aromatik yang paling terkenal merupakan benzena (C6H6). Selain benzena, senyawa hidrokarbon aromatik lainnya termasuk naftalena (C10H8) dan antrasena (C14H10).
- Hidrokarbon Siklik: Hidrokarbon siklik merupakan senyawa hidrokarbon dengan cincin tertutup yang terdiri dari atom karbon. Contoh hidrokarbon siklik termasuk sikloheksana (C6H12), siklopentana (C5H10), dan siklobutana (C4H8).
- Isomer: Isomer merupakan senyawa hidrokarbon dengan rumus molekul yang sama tetapi dengan struktur molekul yang berbeda. Misalnya, isomer dari butana (C4H10) termasuk n-butana (butana normal) dan isobutana (methylpropana).
Ini hanya beberapa jenis yang umum, dan ada banyak lagi varian dan derivatif yang mungkin. Struktur dan sifat dapat bervariasi tergantung pada jumlah atom karbon dalam rantai, ikatan antara atom karbon, dan adanya gugus fungsional lainnya.
Selain itu juga Jenis senyawa hidrokarbon dapat dikelompokkan menjadi dua kategori utama yakni jenuh dan tak jenuh.
- Senyawa Hidrokarbon Jenuh (Hidrokarbon Alifatik Jenuh):
- Alkana: Alkana merupakan hidrokarbon jenuh yang hanya mempunyai ikatan tunggal antara atom karbon dalam molekulnya. Contoh alkana termasuk metana (CH4), etana (C2H6), propana (C3H8), dan butana (C4H10).
- Sikloalkana: Sikloalkana merupakan hidrokarbon jenuh yang mempunyai cincin karbon tertutup dengan hanya ikatan tunggal antara atom karbon dalam cincin. Contoh sikloalkana termasuk sikloheksana (C6H12) dan siklopentana (C5H10).
- Senyawa Hidrokarbon Tak Jenuh (Hidrokarbon Alifatik Tak Jenuh):
- Alkena: Alkena merupakan hidrokarbon tak jenuh yang mempunyai setidaknya satu ikatan rangkap (ikatan ganda) antara atom karbon dalam molekulnya. Contoh alkena termasuk etena (C2H4), propena (C3H6), dan butena (C4H8).
- Alkuna: Alkuna merupakan hidrokarbon tak jenuh yang mempunyai setidaknya satu ikatan rangkap-tunggal (ikatan rangkap ganda-tunggal) antara atom karbon dalam molekulnya. Contoh alkuna termasuk etuna (C2H2), propuna (C3H4), dan butuna (C4H6).
Senyawa hidrokarbon jenuh (alkana, sikloalkana) mempunyai ikatan tunggal antara atom karbon, sedangkan senyawa hidrokarbon tak jenuh (alkena, alkuna) mempunyai ikatan rangkap (ganda maupun ganda-tunggal) antara atom karbon. Perbedaan ini mempengaruhi sifat fisik dan reaktivitas kimia dari senyawa hidrokarbon tersebut. Senyawa hidrokarbon tak jenuh cenderung lebih reaktif dan mempunyai kecenderungan untuk mengalami reaksi adisi, sementara senyawa hidrokarbon jenuh cenderung lebih stabil dan kurang reaktif.
Perlu diingat Senyawa hidrokarbon tak jenuh merupakan yang mempunyai ikatan rangkap (ikatan ganda maupun ikatan rangkap ganda) antara setidaknya dua atom karbon dalam molekulnya. Jenis senyawa hidrokarbon tak jenuh termasuk alkena dan alkuna.
- Alkena: Alkena mempunyai satu maupun lebih ikatan rangkap ganda antara atom karbon dalam molekulnya. Contoh alkena termasuk etena (C2H4), propena (C3H6), dan butena (C4H8). Alkena dapat mengalami reaksi adisi, di mana reagen seperti hidrogen (H2) maupun bromin (Br2) menambahkan atom ke ikatan rangkap ganda, membentuk ikatan tunggal baru.
- Alkuna: Alkuna mempunyai satu maupun lebih ikatan rangkap ganda-tunggal antara atom karbon dalam molekulnya. Contoh alkuna termasuk etuna (C2H2), propuna (C3H4), dan butuna (C4H6). Alkuna juga dapat mengalami reaksi adisi, di mana reagen dapat menambahkan atom ke ikatan rangkap ganda-tunggal, membentuk ikatan rangkap ganda baru.
Zat yang tergolong senyawa hidrokarbon tak jenuh dan mempunyai satu ikatan rangkap tiga merupakan etuna maupun etin (C2H2). Etuna merupakan senyawa hidrokarbon tak jenuh yang mempunyai satu ikatan rangkap-tunggal antara dua atom karbon dalam molekulnya. Rumus molekul etuna merupakan C2H2, yang berarti terdapat dua atom karbon dan dua atom hidrogen dalam molekulnya.
Etuna mempunyai ikatan rangkap-tunggal antara kedua atom karbon, sehingga terdapat satu ikatan rangkap-tiga dalam struktur molekulnya. Senyawa ini juga dikenal sebagai asetilena. Etuna merupakan senyawa hidrokarbon yang reaktif dan sering digunakan dalam berbagai proses kimia dan sintesis organik.
Reaktivitas etuna memungkinkan untuk mengalami berbagai jenis reaksi, termasuk reaksi adisi dan reaksi substitusi. Hal ini membuatnya berguna dalam industri kimia dan sintesis senyawa organik kompleks.
Senyawa hidrokarbon tak jenuh sering digunakan dalam industri kimia dan sintesis organik untuk memproduksi berbagai senyawa dan bahan kimia, seperti plastik, serat sintetis, pelarut, resin, obat-obatan, dan bahan kimia lainnya. Reaktivitas mereka yang lebih tinggi dibandingkan dengan senyawa hidrokarbon jenuh memberikan fleksibilitas dalam memodifikasi ikatan rangkap mereka dan membuat senyawa hidrokarbon tak jenuh berperan penting dalam berbagai aplikasi industri.
Keberadaan Senyawa Hidrokarbon
Senyawa hidrokarbon terbanyak dalam komponen minyak bumi merupakan alkana. Alkana merupakan jenis hidrokarbon jenuh yang hanya mempunyai ikatan tunggal antara atom karbon. Struktur alkana dalam minyak bumi dapat berupa rantai lurus maupun bercabang.
Beberapa contoh alkana yang umum ditemukan dalam minyak bumi merupakan metana (CH4), etana (C2H6), propana (C3H8), butana (C4H10), dan isomer-isomer lainnya. Alkana-alkana ini biasanya menjadi komponen utama dalam fraksi-fraksi minyak bumi yang disebut sebagai gas alam, bensin, dan minyak diesel.
Selain alkana, minyak bumi juga mengandung jenis hidrokarbon lainnya seperti alkena (mengandung ikatan rangkap antara atom karbon) dan sikloalkana (berbentuk cincin tertutup). Namun, jumlahnya biasanya lebih sedikit dibandingkan dengan alkana.
Komposisi pasti dalam minyak bumi dapat bervariasi tergantung pada sumber dan jenis minyak bumi yang diekstraksi. Proses pemurnian dan fraksinasi digunakan untuk memisahkan senyawa-senyawa hidrokarbon ini menjadi berbagai fraksi yang mempunyai berbagai rentang keberatannya, yang kemudian digunakan dalam berbagai industri dan aplikasi.
Senyawa hidrokarbon dapat ditemukan di berbagai tempat dan mempunyai keberadaan yang meliputi:
- Sumber Alam: Hidrokarbon dapat ditemukan secara alami di bumi. Minyak bumi dan gas alam merupakan contoh utama sumber alam hidrokarbon. Minyak bumi terbentuk dari sisa-sisa organisme laut purba yang terperangkap dalam lapisan bumi dan mengalami proses pengubahan selama jutaan tahun. Gas alam terdiri dari berbagai hidrokarbon, terutama metana.
- Industri Minyak dan Gas: Senyawa ini digunakan secara luas dalam industri minyak dan gas. Minyak bumi dieksplorasi dan diekstraksi untuk menghasilkan berbagai produk, seperti bahan bakar, pelumas, dan bahan baku untuk industri kimia. Gas alam digunakan sebagai sumber energi dan bahan baku dalam industri kimia.
- Bahan Bakar dan Energi: Hidrokarbon merupakan sumber energi yang penting. Bensin, minyak diesel, dan gas alam digunakan sebagai bahan bakar untuk kendaraan, pemanasan rumah, dan pembangkit listrik. Selain itu, bahan bakar padat seperti batu bara dan minyak tanah juga mengandung hidrokarbon.
- Industri Kimia: digunakan dalam industri kimia untuk memproduksi berbagai produk. Plastik, serat sintetis, pelarut, obat-obatan, pupuk, pestisida, kosmetik, dan banyak produk lainnya dibuat dari hidrokarbon. Industri kimia sangat bergantung pada hidrokarbon sebagai bahan baku.
- Lingkungan: Hidrokarbon juga ditemukan dalam lingkungan sebagai hasil dari aktivitas manusia dan alami. Emisi gas buang kendaraan bermotor, industri, dan pembakaran biomassa mengandung hidrokarbon yang dapat berkontribusi pada polusi udara dan perubahan iklim.
Keberadaan senyawa ini mencakup sumber alam, industri, dan dampak pada lingkungan. Penting untuk mengelola dan memanfaatkan hidrokarbon dengan bijak untuk menjaga keseimbangan antara kebutuhan manusia dan perlindungan lingkungan.
Sifat Senyawa Hidrokarbon
Senyawa hidrokarbon mempunyai sifat-sifat yang penting untuk dipahami dalam kimia organik. Berikut merupakan beberapa sifat umum dari senyawa hidrokarbon:
Sifat Nonpolar
Secara umum, senyawa hidrokarbon merupakan nonpolar karena terdiri dari atom karbon dan hidrogen yang mempunyai perbedaan keelektronegativan yang rendah. Akibatnya, senyawa hidrokarbon tidak larut dalam pelarut polar seperti air, tetapi larut dalam pelarut nonpolar seperti pelarut organik.
Titik Didih dan Titik Leleh
Titik didih senyawa hidrokarbon bervariasi tergantung pada jenis dan ukuran molekulnya. Secara umum, semakin besar molekul senyawa hidrokarbon, semakin tinggi titik didihnya. Hal ini disebabkan oleh kekuatan tarik antarmolekul yang lebih besar pada molekul yang lebih besar.
Berikut ini merupakan beberapa contoh titik didih senyawa hidrokarbon umum:
- Metana (CH4): -161,5 °C (-258,7 °F)
- Etana (C2H6): -88,6 °C (-127,5 °F)
- Propana (C3H8): -42,1 °C (-43,8 °F)
- Isobutana (C4H10): -11,7 °C (10.9 °F)
- Pentana (C5H12): 36,1 °C (97 °F)
- Heksana (C6H14): 68,7 °C (155,7 °F)
- Heptana (C7H16): 98,4 °C (209,1 °F)
- Oktana (C8H18): 125,6 °C (258,1 °F)
- Nonana (C9H20): 150,8 °C (303,4 °F)
- Dekana (C10H22): 174,1 °C (345,4 °F)
Diantara senyawa hidrokarbon berikut, senyawa yang didihnya paling rendah merupakan metana (CH4). Metana merupakan senyawa hidrokarbon sederhana yang terdiri dari satu atom karbon dan empat atom hidrogen. Ini merupakan senyawa yang paling sederhana dan mempunyai berat molekul yang paling rendah di antara alkana.
Karena metana mempunyai ikatan tunggal antara atom karbon dan hanya mempunyai satu atom karbon, molekulnya mempunyai kekuatan tarik antarmolekul (intermolekul) yang lemah. Hal ini mengakibatkan energi yang dibutuhkan untuk memutuskan ikatan antarmolekul dan mengubah metana menjadi bentuk uap lebih rendah daripada senyawa hidrokarbon yang lebih besar dan lebih kompleks.
Akibatnya, metana mempunyai titik didih yang paling rendah di antara senyawa hidrokarbon yang diberikan. Pada tekanan atmosfer, titik didih metana merupakan sekitar -161,5 °C (-258,7 °F).
Senyawa hidrokarbon lainnya seperti etana (C2H6), propana (C3H8), dan butana (C4H10) mempunyai titik didih yang lebih tinggi dibandingkan dengan metana karena mereka mempunyai lebih banyak atom karbon dalam rantai hidrokarbon mereka. Semakin banyak atom karbon dalam molekul, semakin besar ikatan antarmolekul dan semakin tinggi titik didih senyawa tersebut.
Perlu dicatat bahwa titik didih dapat bervariasi tergantung pada tekanan atmosfer. Nilai-nilai yang diberikan di atas merupakan pada tekanan atmosfer standar (1 atmosfer maupun 101,3 kPa). Titik didih senyawa hidrokarbon yang lebih besar daripada dekana akan semakin tinggi, sementara senyawa dengan rantai karbon yang lebih pendek akan mempunyai titik didih yang lebih rendah.
Reaktivitas Kimia
Hidrokarbon cenderung stabil secara kimia, tetapi reaktivitas mereka dapat dipengaruhi oleh jenis ikatan dan substituen yang ada dalam molekul. Misalnya, alkena dengan ikatan rangkap dapat mengalami reaksi adisi untuk membentuk senyawa baru. Senyawa hidrokarbon juga dapat mengalami reaksi oksidasi dan reaksi substitusi tertentu, tergantung pada kondisi dan reagen yang ada.
Unsur yang umum terlibat dalam reaksi hidrokarbon merupakan karbon (C) dan hidrogen (H), karena hidrokarbon terdiri dari atom karbon dan hidrogen. Namun, selain itu, unsur-unsur lain juga dapat terlibat dalam reaksi dengan hidrokarbon tergantung pada kondisi dan jenis reaksi yang terjadi. Berikut merupakan beberapa contoh reaksi unsur dengan senyawa hidrokarbon:
- Oksigen (O): Oksigen dapat terlibat dalam reaksi pembakaran hidrokarbon. Ketika senyawa hidrokarbon bereaksi dengan oksigen dalam kondisi yang tepat, seperti pembakaran, akan terjadi reaksi oksidasi di mana hidrokarbon akan mengalami pembakaran dan menghasilkan karbon dioksida (CO2) dan air (H2O) sebagai produk akhirnya.
- Hidrogen (H): Hidrogen dapat terlibat dalam reaksi adisi dengan senyawa hidrokarbon tak jenuh seperti alkena dan alkuna. Dalam reaksi adisi hidrogen, hidrogen menambahkan ke ikatan rangkap dalam senyawa hidrokarbon untuk membentuk senyawa hidrokarbon jenuh. Contohnya merupakan reaksi hidrogenasi alkena menjadi alkana menggunakan katalisator seperti logam paladium (Pd) maupun nikel (Ni).
- Halogen (F, Cl, Br, I): Halogen dapat terlibat dalam reaksi substitusi dengan senyawa hidrokarbon. Dalam reaksi halogenasi, satu maupun lebih atom hidrogen dalam senyawa hidrokarbon digantikan oleh atom halogen. Contohnya merupakan reaksi klorinasi metana (CH4) untuk menghasilkan klorometana (CH3Cl) dan hidrogen klorida (HCl).
- Belerang (S): Belerang dapat terlibat dalam reaksi dengan senyawa hidrokarbon untuk membentuk senyawa hidrokarbon sulfur. Contohnya merupakan reaksi hidrogenasi senyawa hidrokarbon tak jenuh dengan belerang, seperti hidrogenasi senyawa hidrokarbon dengan kandungan sulfur tinggi dalam proses pemurnian minyak bumi.
- Logam: Logam tertentu dapat berperan sebagai katalis dalam reaksi dengan senyawa hidrokarbon. Contohnya merupakan penggunaan katalis logam seperti platina (Pt), paladium (Pd), dan nikel (Ni) dalam berbagai reaksi hidrogenasi, dehidrogenasi, dan isomerisasi senyawa hidrokarbon.
Selain unsur-unsur di atas, senyawa hidrokarbon juga dapat terlibat dalam reaksi dengan unsur-unsur lain, seperti nitrogen (N), fosforus (P), dan unsur lainnya tergantung pada jenis reaksi yang terjadi. Reaksi senyawa hidrokarbon dapat sangat bervariasi tergantung pada kondisi, katalis, dan jenis senyawa hidrokarbon yang terlibat.
Senyawa hidrokarbon yang tidak mengalami reaksi adisi merupakan benzena (C6H6). Benzena merupakan senyawa hidrokarbon aromatik yang mempunyai cincin heksagonal stabil dengan ikatan rangkap resonansi di antara atom karbon. Karena ikatan rangkap resonansi ini, benzena mempunyai struktur khusus yang membuatnya tidak mudah mengalami reaksi adisi seperti senyawa hidrokarbon lainnya.
Reaksi adisi umumnya terjadi ketika senyawa hidrokarbon dengan ikatan rangkap (seperti alkena maupun alkuna) bereaksi dengan reagen yang dapat menambahkan atom maupun gugus fungsional ke ikatan rangkap tersebut. Namun, benzena tidak mempunyai ikatan rangkap yang dapat mudah bereaksi dengan reagen adisi karena struktur aromatiknya yang stabil.
Sebagai gantinya, benzena cenderung mengalami reaksi substitusi, di mana satu maupun lebih atom hidrogen dalam cincin aromatik digantikan oleh gugus fungsional. Contohnya merupakan reaksi nitrosasi benzena, di mana gugus nitro (NO2) menggantikan salah satu atom hidrogen dalam cincin bensena.
Dengan demikian, benzena merupakan contoh senyawa hidrokarbon yang tidak mengalami reaksi adisi, tetapi lebih mungkin mengalami reaksi substitusi pada cincin aromatiknya.
Pembakaran
Hidrokarbon merupakan bahan bakar yang penting karena dapat mengalami reaksi pembakaran dengan oksigen. Reaksi pembakaran hidrokarbon menghasilkan karbon dioksida (CO2) dan air (H2O) sebagai produk akhirnya, serta melepaskan energi dalam bentuk panas dan cahaya.
Senyawa hidrokarbon yang mempunyai nilai oktan terendah merupakan metana (CH4). Oktan merupakan parameter yang digunakan untuk mengukur resistensi terhadap ketukan maupun detonasinya bahan bakar dalam mesin pembakaran dalam. Semakin tinggi nilai oktan, semakin tahan bahan bakar terhadap ketukan yang tidak diinginkan saat terbakar di dalam mesin.
Metana mempunyai nilai oktan yang sangat rendah, yaitu sekitar 20-30. Hal ini disebabkan oleh sifat kimia dan fisik metana yang membuatnya mudah terbakar dan cenderung untuk mengalami ketukan maupun detonasi yang tidak terkendali di dalam mesin. Oleh karena itu, metana umumnya tidak digunakan sebagai bahan bakar kendaraan bermotor konvensional.
Sebagai perbandingan, bensin yang digunakan dalam kendaraan umumnya mempunyai nilai oktan antara 87 hingga 93. Ini berarti bensin mempunyai ketahanan yang lebih baik terhadap ketukan saat terbakar dalam mesin pembakaran dalam dibandingkan dengan metana.
Dalam prakteknya, metana lebih sering digunakan sebagai bahan bakar dalam aplikasi yang khusus, seperti kendaraan yang menggunakan bahan bakar gas alam terkompresi (CNG) maupun sebagai sumber energi dalam industri dan rumah tangga.
Untuk membuktikan adanya karbon dioksida (CO2) dari hasil pembakaran senyawa hidrokarbon, Anda dapat menggunakan beberapa metode berikut:
- Penggunaan Larutan Indikator pH: CO2 larut dalam air membentuk asam karbonat, yang dapat mengasamkan larutan. Anda dapat menggunakan larutan indikator pH seperti fenolftalein maupun bromtimol biru. Jika CO2 hadir, larutan akan berubah menjadi asam dan mengubah warna indikator pH.
- Reaksi dengan Hidrokarbonat: CO2 dapat bereaksi dengan senyawa hidrokarbonat, seperti larutan natrium hidrokarbonat (NaHCO3). Jika Anda mengalirkan gas hasil pembakaran hidrokarbon melalui larutan NaHCO3, akan terbentuk gelembung dan perubahan warna pada larutan, menunjukkan adanya CO2.
- Penggunaan Pengukur CO2: Anda dapat menggunakan pengukur CO2 yang dirancang khusus untuk mendeteksi keberadaan CO2 dalam udara. Pengukur ini biasanya bekerja dengan mengukur perubahan resistansi listrik maupun perubahan warna indikator yang terjadi akibat interaksi dengan CO2.
- Penggunaan Tes Gelembung: Ambil tabung reaksi maupun wadah lain yang terisi dengan air dan letakkan ujung selang maupun pipa yang mengeluarkan gas hasil pembakaran hidrokarbon ke dalam air. Jika ada CO2, akan terjadi pembentukan gelembung udara di dalam air.
- Penggunaan Spektrometer Inframerah: Metode ini memerlukan instrumen spektrometer inframerah yang mampu mendeteksi panjang gelombang yang khas dari vibrasi molekuler CO2. Dengan menggunakan spektrometer ini, Anda dapat mengidentifikasi adanya puncak absorpsi yang sesuai dengan CO2.
Penting untuk diingat bahwa pengujian ini harus dilakukan dengan hati-hati dan dengan memperhatikan langkah-langkah keselamatan yang tepat saat bekerja dengan gas hasil pembakaran dan bahan kimia terkait. Jika Anda tidak yakin maupun tidak mempunyai pengalaman yang cukup, disarankan untuk berkonsultasi dengan ahli maupun melakukan percobaan di bawah pengawasan yang kompeten.
Keberadaan Fase
Senyawa ini umumnya dapat berada dalam fase padat, cair, maupun gas, tergantung pada suhu dan tekanan. Hidrokarbon dengan jumlah atom karbon yang rendah cenderung berada dalam fase gas pada suhu dan tekanan normal. Ketika jumlah atom karbon meningkat, hidrokarbon dapat berada dalam fase cair dan padat pada suhu dan tekanan tertentu.
Kelarutan
Senyawa ini biasanya tidak larut dalam air karena sifat nonpolarnya. Namun, mereka larut dalam pelarut nonpolar seperti pelarut organik (misalnya, heksana, toluena) karena molekul-molekul hidrokarbon dapat saling berinteraksi melalui gaya London.
Sifat-sifat ini dapat bervariasi tergantung pada struktur, substituen, dan kondisi kimia tertentu. Oleh karena itu, penting untuk mempertimbangkan sifat-sifat khusus senyawa hidrokarbon yang sedang dipelajari.
Struktur Senyawa Hidrokarbon
Senyawa hidrokarbon mempunyai beragam struktur, tergantung pada jumlah atom karbon dan pengaturan ikatan antara atom karbon dalam molekul. Berikut ini merupakan beberapa struktur umum yang dapat ditemui dalam senyawa hidrokarbon:
- Rantai Lurus: Ini merupakan struktur paling sederhana di mana atom karbon saling terhubung membentuk rantai lurus. Contoh termasuk metana (CH4), etana (C2H6), propana (C3H8), dan seterusnya.
- Rantai Bercabang: Atom karbon dalam senyawa ini dapat bercabang, membentuk struktur yang lebih kompleks. Contoh merupakan isobutana (C4H10), yang mempunyai rantai utama tiga atom karbon dengan satu atom karbon cabang.
- Cincin Tertutup: Senyawa ini juga dapat membentuk cincin tertutup, seperti sikloheksana (C6H12) maupun siklopentana (C5H10). Dalam struktur ini, atom karbon membentuk cincin dengan ikatan tunggal antara atom-atom karbon dalam cincin tersebut.
- Ikatan Rangkap: Senyawa ini juga dapat mempunyai ikatan rangkap, yang menghasilkan senyawa alkena dan alkuna. Alkena mempunyai satu ikatan rangkap antara dua atom karbon, seperti etena (C2H4). Sedangkan alkuna mempunyai ikatan rangkap tiga, seperti etuna (C2H2).
- Senyawa Aromatik: Struktur khusus dalam hidrokarbon merupakan senyawa aromatik, yang mempunyai cincin karbon stabil dengan ikatan rangkap resonansi. Contoh paling terkenal merupakan benzena (C6H6).
Senyawa hidrokarbon dapat mempunyai struktur yang lebih kompleks dengan rantai karbon yang panjang, cabang yang lebih banyak, maupun kombinasi dari berbagai struktur di atas. Kemungkinan variasi struktur hidrokarbon sangat luas dan mempunyai dampak signifikan pada sifat dan reaktivitas kimianya.
Kegunaan Senyawa Hidrokarbon
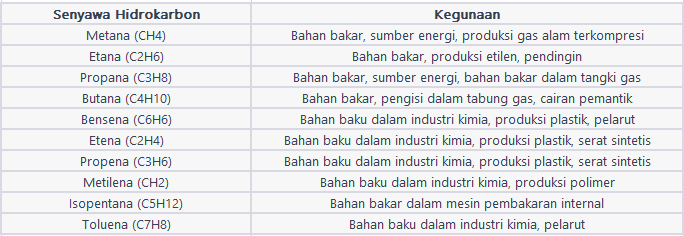
Senyawa hidrokarbon mempunyai berbagai kegunaan yang penting dalam berbagai aspek kehidupan. Berikut merupakan beberapa contoh kegunaan senyawa hidrokarbon:
- Bahan Bakar: Hidrokarbon merupakan sumber utama bahan bakar yang digunakan dalam transportasi dan pembangkit listrik. Bensin, minyak diesel, dan gas alam digunakan sebagai bahan bakar untuk kendaraan bermotor. Hidrokarbon juga digunakan dalam pembangkit listrik untuk menghasilkan energi.
- Industri Kimia: Hidrokarbon digunakan sebagai bahan baku dalam industri kimia. Mereka digunakan untuk memproduksi berbagai produk, seperti plastik, serat sintetis, pelarut, resin, lilin, obat-obatan, kosmetik, pupuk, dan banyak lagi. Industri kimia sangat bergantung pada hidrokarbon untuk sintesis dan pembuatan berbagai senyawa organik.
- Material Konstruksi: Hidrokarbon digunakan dalam pembuatan berbagai material konstruksi. Plastik, yang terbuat dari hidrokarbon, digunakan dalam berbagai aplikasi, termasuk kemasan, pipa, kabel listrik, komponen otomotif, dan banyak lagi. Bahan seperti aspal, yang merupakan senyawa hidrokarbon, digunakan dalam pembuatan jalan dan bahan tahan air.
- Industri Energi: Hidrokarbon berperan dalam industri energi melalui produksi minyak bumi dan gas alam. Minyak bumi dan gas alam digunakan sebagai sumber energi untuk pemanasan, pendinginan, pembangkit listrik, dan proses industri lainnya.
- Pelarut: Senyawa seperti heksana, toluena, dan xilena digunakan sebagai pelarut dalam berbagai aplikasi industri, termasuk produksi cat, tinta, lem, pembersih, dan industri farmasi.
- Industri Farmasi: Banyak digunakan dalam industri farmasi untuk produksi obat-obatan. Molekul hidrokarbon sering menjadi kerangka dasar untuk sintesis senyawa farmasi yang lebih kompleks.
- Produk Konsumen: Hidrokarbon digunakan dalam produksi berbagai produk konsumen, termasuk kosmetik, deterjen, parfum, lilin, dan produk perawatan pribadi lainnya.
- Industri Petrokimia: Industri petrokimia menggunakan hidrokarbon sebagai bahan baku untuk produksi berbagai produk kimia, seperti pupuk, pestisida, bahan kimia pertanian, dan banyak lagi.
Inilah hanya beberapa contoh kegunaan senyawa hidrokarbon. Senyawa ini mempunyai peran krusial dalam berbagai industri dan aplikasi di seluruh dunia.
Contoh Senyawa Hidrokarbon
Berikut merupakan beberapa contoh senyawa hidrokarbon:
- Metana (CH4): Senyawa paling sederhana yang terdiri dari satu atom karbon dan empat atom hidrogen. Ini merupakan komponen utama gas alam.
- Etena (C2H4): Senyawa dengan ikatan rangkap antara dua atom karbon. Digunakan dalam industri kimia sebagai bahan baku untuk sintesis senyawa organik lainnya.
- Propena (C3H6): Senyawa dengan ikatan rangkap antara dua atom karbon. Digunakan dalam industri petrokimia untuk produksi plastik dan serat sintetis.
- Butilena (C4H8): Senyawa dengan ikatan rangkap antara dua atom karbon. Digunakan dalam produksi butadiena, yang merupakan bahan baku untuk karet sintetis.
- Sikloheksana (C6H12): Senyawa dengan struktur cincin heksagonal tertutup. Digunakan sebagai pelarut dalam industri kimia dan dalam produksi plastik.
- Bensena (C6H6): Senyawa aromatik dengan cincin heksagonal. Digunakan sebagai bahan baku dalam industri kimia untuk produksi bahan kimia organik lainnya.
- Heptana (C7H16): Senyawa dengan rantai karbon tujuh atom. Digunakan sebagai bahan bakar dalam mesin pembakaran internal.
- Oktana (C8H18): Senyawa dengan rantai karbon delapan atom. Digunakan sebagai standar untuk mengukur angka oktan bensin.
- Nonana (C9H20): Senyawa dengan rantai karbon sembilan atom.
- Dekana (C10H22): Senyawa dengan rantai karbon sepuluh atom. Digunakan dalam produksi bensin dan bahan bakar lainnya.
Ini hanyalah beberapa contoh senyawa hidrokarbon, dan ada banyak senyawa hidrokarbon lainnya dengan ukuran dan struktur yang berbeda.
Referensi
beberapa referensi yang dapat Anda gunakan untuk mendapatkan informasi lebih lanjut tentang senyawa Hidrokarbon:
- Buchwald, S. L., dan Nielsen, R. J. (2003). Amines, Aliphatic. In Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH.
- NIOSH Pocket Guide to Chemical Hazards. (2019).
- PubChem Compound Database.
- Merck Index Online.
- United States Patent and Trademark Office. Patent Database.