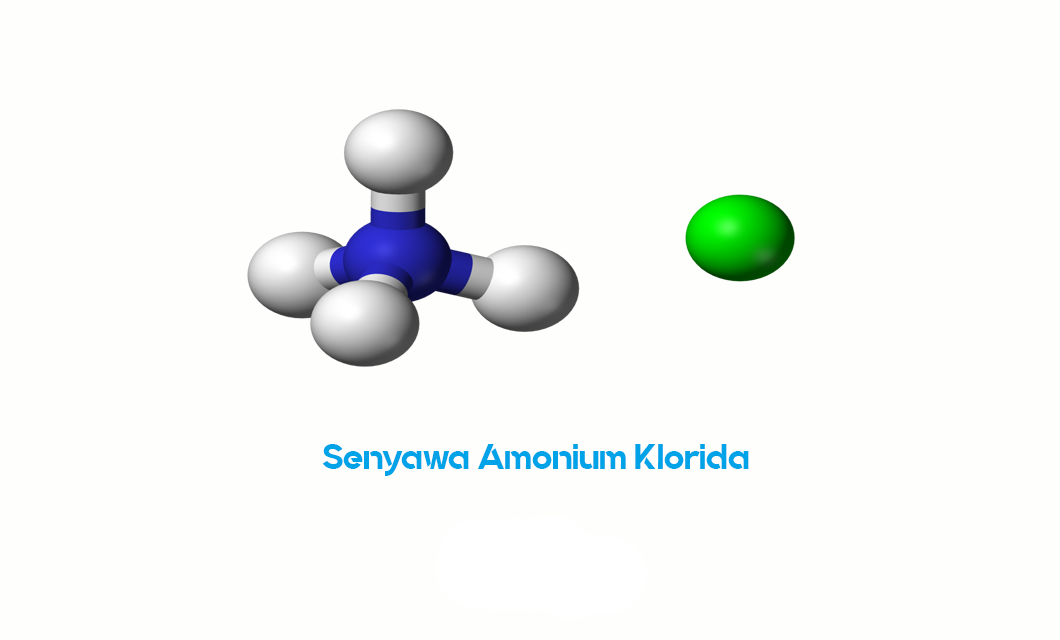
Senyawa Amonium klorida (NH4Cl) merupakan senyawa anorganik dengan terdiri dari ion amonium (NH4+) juga ion klorida (Cl-). Senyawa ini dikenal sebagai garam amonium maupun garam aditif E510 yangg sering digunakan dalam berbagai aplikasi industri atau laboratorium. Amonium klorida mempunyai sifat unik sehigga berguna dalam berbagai konteks.
Secara umum, amonium klorida dapat dibuat melalui reaksi antara amonia (NH3) dengan asam klorida (HCl). Selama reaksi ini, amonia berperan sebagai basa, menerima proton dari asam klorida kemudian membentuk ion amonium (NH4+), sementara asam klorida kehilangan proton sehingga membentuk ion klorida (Cl-). Hasilnya merupakan kristal putih berbentuk kubus maupun kristal padat lainnya yang larut dalam air.
Amonium klorida mempunyai beberapa kegunaan penting. Salah satu penggunaan utamanya merupakan dalam industri pembuatan pupuk, di mana senyawa ini digunakan sebagai sumber nitrogen untuk tanaman. Amonium klorida juga digunakan dalam produksi kertas, tekstil, atau pemurnian logam. Selain itu, senyawa ini mempunyai sifat sangat berguna dalam laboratorium, seperti digunakan dalam elektrolit untuk sel elektrokimia atau juga sebagai bahan dalam reaksi kimia tertentu.
Namun, perlu diperhatikan bahwa amonium klorida mempunyai beberapa sifat yang perlu diwaspadai. Saat dipanaskan, senyawa ini dapat menguap sehingga menghasilkan uap yang dapat mengiritasi saluran pernapasan. Oleh karena itu, penggunaannya dalam area tidak terlalu terkendali harus dilakukan dengan hati-hati atau dengan memperhatikan langkah-langkah keselamatan sesuai SOP atau tepat.
Secara keseluruhan, amonium klorida merupakan senyawa anorganik penting, sehingga serbaguna dengan berbagai aplikasi di industri atau laboratorium. Sifat-sifatnya unik dan kemampuannya sebagai sumber nitrogen membuatnya berperan penting dalam berbagai proses atau produksi.
Sejarah Senyawa Amonium Klorida
Sejarah senyawa amonium klorida bermula pada abad ke-13 Masehi di Eropa. Pada saat itu, para alkemis mengamati bahwa ketika mereka menggabungkan urin manusia dengan batu tawas (alum) maupun asam, mereka mendapatkan endapan putih yang dapat membakar dengan hebat. Endapan ini kemudian dikenal sebagai “sal ammoniac” maupun “ammonium salt” yang merupakan amonium klorida.
Pada awalnya, senyawa ini diekstraksi dari urin manusia yang mengandung amonia. Namun, karena sifatnya yang kurang praktis, metode ini kemudian digantikan oleh proses pembuatan amonium klorida melalui reaksi antara amonia dan asam klorida. Proses ini dikembangkan pada abad ke-16 oleh alkimis seperti Conrad Gessner dan Libavius.
Penggunaan amonium klorida sebagai bahan kimia dan obat-obatan semakin berkembang pada abad ke-17. Senyawa ini digunakan dalam industri tekstil untuk mencerahkan warna kain, dalam industri logam untuk pemurnian logam, dan dalam produksi kertas sebagai pengatur pH. Amonium klorida juga digunakan sebagai obat ekspektoran dalam pengobatan batuk dan pilek.
Selama bertahun-tahun, penggunaan amonium klorida semakin meluas dalam berbagai industri. Pada abad ke-19, senyawa ini ditemukan sebagai pupuk yang efektif dalam menyediakan nutrisi nitrogen untuk tanaman. Penggunaan amonium klorida sebagai sumber nitrogen dalam pupuk tetap menjadi salah satu aplikasi utamanya hingga saat ini.
Dalam perkembangan industri kimia modern, amonium klorida diproduksi secara massal melalui proses sintesis. Proses ini melibatkan reaksi antara amonia dan asam klorida dalam reaktor yang dikendalikan secara ketat untuk menghasilkan amonium klorida yang murni.
Dengan demikian, sejarah senyawa amonium klorida mencakup perkembangan dari penggunaan tradisional sebagai bahan kimia dan obat-obatan hingga aplikasinya yang luas dalam industri pupuk, tekstil, logam, dan banyak lagi. Senyawa ini terus menjadi bahan penting dalam berbagai proses industri dan aplikasi di dunia modern.
Karakteristik Senyawa Amonium Klorida
Berikut ini merupakan tabel yang menjelaskan karakteristik senyawa amonium klorida:
| Karakteristik | Deskripsi |
|---|---|
| Rumus kimia | NH4Cl |
| Nama IUPAC | Amonium klorida |
| Tipe senyawa | Senyawa anorganik |
| Struktur kimia | Ion amonium (NH4+) berikatan dengan ion klorida (Cl-) |
| Warna | Putih |
| Bau | Tanpa bau khas |
| Bentuk fisik | Kristal padat maupun bubuk |
| Kelarutan dalam air | Larut dalam air |
| Titik lebur | Sekitar 338 °C |
| Titik didih | Tidak berlaku, senyawa ini terurai menjadi amonia (NH3) dan asam klorida (HCl) saat dipanaskan |
| Sifat asam-basa | Bersifat asam, membentuk ion hidrogen (H+) dalam larutan |
| pH larutan | Bersifat asam, pH kurang dari 7 dalam larutan yang jenuh dengan amonium klorida |
| Sifat penghantar listrik | Konduktor listrik dalam larutan yang terionisasi |
| Toksisitas | Tidak tergolong sebagai senyawa yang sangat beracun, namun harus digunakan dengan hati-hati |
| Penggunaan umum | Pupuk, industri kertas, industri tekstil, pemurnian logam, obat batuk |
Tabel di atas memberikan gambaran umum tentang beberapa karakteristik penting dari senyawa amonium klorida, termasuk rumus kimia, sifat fisik, sifat kimia, kelarutan, penggunaan umum, dan lain-lain. Perlu dicatat bahwa sifat-sifat ini dapat bervariasi tergantung pada kondisi spesifik dan lingkungan di mana senyawa ini digunakan maupun diamati.
Amonium klorida (NH4Cl) mempunyai sejumlah karakteristik yang menentukan sifat-sifatnya. Berikut merupakan penjelasan tentang beberapa karakteristik utama senyawa amonium klorida:
- Rumus Kimia: Amonium klorida mempunyai rumus kimia NH4Cl, yang menunjukkan bahwa senyawa ini terdiri dari satu atom nitrogen (N) yang terikat dengan empat atom hidrogen (H) membentuk ion amonium (NH4+), dan satu atom klorin (Cl) membentuk ion klorida (Cl-).
- Struktur Kimia: Secara struktural, amonium klorida terdiri dari kristal padat maupun bubuk putih. Dalam kristal, ion amonium (NH4+) dan ion klorida (Cl-) saling berikatan secara elektrostatis membentuk sebuah kisi kristal.
- Kelarutan dalam Air: Amonium klorida larut dengan baik dalam air. Ketika senyawa ini dilarutkan dalam air, ion amonium dan ion klorida terpisah dan tersebar merata dalam larutan.
- Sifat Asam-Basa: Amonium klorida mempunyai sifat asam, yang berarti senyawa ini dapat melepaskan ion hidrogen (H+) ke dalam larutan. Ion amonium (NH4+) dapat berperilaku sebagai asam lemah dan membentuk ion hidrogen (H+) ketika bereaksi dengan air.
- Konduktivitas Listrik: Amonium klorida merupakan konduktor listrik dalam larutan yang terionisasi. Ketika larutan amonium klorida terdissosiasi, ion-ionnya dapat bergerak dan membawa muatan listrik, sehingga memungkinkan larutan untuk menghantarkan listrik.
- Titik Lebur: Amonium klorida mempunyai titik lebur sekitar 338 °C. Pada suhu ini, senyawa ini berubah dari keadaan padat menjadi cair.
- Penggunaan Umum: Amonium klorida mempunyai berbagai penggunaan dalam industri dan laboratorium. Senyawa ini digunakan sebagai pupuk untuk menyediakan nutrisi nitrogen bagi tanaman. Selain itu, amonium klorida digunakan dalam industri kertas untuk pengatur pH, dalam industri tekstil untuk mencerahkan warna kain, dan dalam pemurnian logam. Senyawa ini juga digunakan dalam obat batuk sebagai agen ekspektoran.
- Toksisitas: Amonium klorida tidak tergolong sebagai senyawa yang sangat beracun. Namun, ketika dipanaskan, senyawa ini dapat menguap dan menghasilkan uap yang dapat mengiritasi saluran pernapasan. Oleh karena itu, penggunaan amonium klorida harus dilakukan dengan hati-hati dan memperhatikan langkah-langkah keselamatan yang tepat.
Karakteristik-karakteristik ini memberikan pemahaman tentang sifat-sifat fisik, kimia, dan penggunaan senyawa amonium klorida dalam berbagai konteks.
Fungsi Senyawa Amonium Klorida
Senyawa amonium klorida (NH4Cl) mempunyai berbagai fungsi dan aplikasi dalam berbagai industri dan bidang. Berikut ini merupakan beberapa fungsi utama dari amonium klorida:
- Pupuk: Amonium klorida digunakan sebagai sumber nutrisi nitrogen dalam pupuk. Karena mengandung ion amonium (NH4+), senyawa ini dapat memberikan nutrisi penting bagi pertumbuhan tanaman. Pupuk amonium klorida terutama digunakan pada tanaman yang membutuhkan suplai nitrogen cepat, seperti tanaman sayuran, tanaman buah-buahan, dan rumput.
- Industri Tekstil: Amonium klorida digunakan dalam industri tekstil sebagai agen mordan, yaitu zat yang membantu mengikat zat warna ke serat tekstil. Senyawa ini digunakan untuk mencerahkan warna kain dan meningkatkan ketahanan serat terhadap pencucian dan perubahan suhu.
- Industri Kertas: Dalam industri kertas, amonium klorida digunakan sebagai pengatur pH dalam proses produksi pulp dan kertas. Senyawa ini membantu menjaga pH optimal selama tahap pemutihan pulp dan mengontrol keasaman selama produksi kertas.
- Pemurnian Logam: Amonium klorida digunakan dalam proses pemurnian logam. Senyawa ini berperan dalam penghilangan oksida logam yang tidak diinginkan dan membantu menghasilkan logam yang lebih murni.
- Obat Batuk dan Ekspektoran: Amonium klorida juga digunakan dalam industri farmasi sebagai bahan dalam pembuatan obat batuk dan ekspektoran. Senyawa ini membantu dalam mengencerkan dan mengeluarkan dahak dari saluran pernapasan, membantu meredakan batuk.
- Elektrokimia: Amonium klorida dapat digunakan sebagai elektrolit dalam sel elektrokimia. Senyawa ini memfasilitasi aliran arus listrik dalam sel, yang penting dalam aplikasi seperti baterai dan sel elektrokimia lainnya.
- Pengolahan Air: Amonium klorida juga dapat digunakan dalam pengolahan air sebagai agen pengendap dan pembersih. Senyawa ini membantu mengendapkan partikel-partikel padat dan menghilangkan kekeruhan dalam air.
Selain fungsi-fungsi di atas, amonium klorida juga dapat digunakan dalam berbagai aplikasi laboratorium, seperti dalam analisis kimia dan sintesis senyawa lainnya.
Penting untuk diingat bahwa penggunaan amonium klorida harus dilakukan sesuai dengan pedoman keamanan dan dosis yang tepat, tergantung pada konteks dan aplikasinya.
Kegunaan Senyawa Amonium Klorida
Senyawa amonium klorida (NH4Cl) mempunyai berbagai kegunaan dalam berbagai bidang. Berikut ini merupakan beberapa kegunaan utama amonium klorida:
- Pupuk: Amonium klorida digunakan sebagai pupuk untuk menyediakan nutrisi nitrogen bagi tanaman. Senyawa ini merupakan sumber nitrogen yang cepat dan efektif, membantu meningkatkan pertumbuhan dan produktivitas tanaman.
- Industri Tekstil: Amonium klorida digunakan dalam industri tekstil sebagai agen mordan. Senyawa ini membantu meningkatkan daya serap pewarna pada serat tekstil, memperkuat ikatan warna, dan meningkatkan ketahanan serat terhadap pencucian.
- Industri Kertas: Dalam industri kertas, amonium klorida digunakan sebagai pengatur pH dalam proses produksi pulp dan kertas. Senyawa ini membantu menjaga pH optimal selama tahap pemutihan pulp, mencegah penguraian serat kertas, dan mengontrol keasaman selama produksi kertas.
- Industri Logam: Amonium klorida digunakan dalam pemurnian logam. Senyawa ini membantu menghilangkan oksida logam yang tidak diinginkan dan memperoleh logam yang lebih murni. Amonium klorida juga digunakan dalam proses galvanisasi untuk melapisi logam dengan lapisan pelindung.
- Pengolahan Air: Amonium klorida dapat digunakan dalam pengolahan air sebagai agen pengendap dan pembersih. Senyawa ini membantu mengendapkan partikel-padatan dan menghilangkan kekeruhan dalam air, membantu meningkatkan kualitas air.
- Industri Farmasi: Amonium klorida digunakan dalam produksi obat-obatan, terutama sebagai bahan dalam pembuatan obat batuk dan ekspektoran. Senyawa ini membantu melonggarkan dahak dan meringankan batuk.
- Elektrokimia: Amonium klorida digunakan sebagai elektrolit dalam berbagai aplikasi elektrokimia, seperti baterai dan sel elektrokimia lainnya. Senyawa ini membantu dalam aliran arus listrik dalam sel dan mendukung fungsi sel elektrokimia.
Selain itu, amonium klorida juga digunakan dalam berbagai aplikasi laboratorium, seperti dalam analisis kimia dan sintesis senyawa kimia.
Perlu diingat bahwa penggunaan amonium klorida harus dilakukan sesuai dengan pedoman keamanan yang tepat, mengingat sifat korosifnya. Selalu patuhi instruksi penggunaan dan kenakan perlindungan yang sesuai saat menangani senyawa ini.
Contoh Senyawa Amonium Klorida
Berikut merupakan beberapa contoh senyawa yang mengandung amonium klorida (NH4Cl):
- Amonium klorida padat (NH4Cl): Ini merupakan bentuk umum amonium klorida yang berupa kristal padat maupun bubuk putih. Senyawa ini sering digunakan dalam industri pupuk, tekstil, kertas, dan logam.
- Amonium klorida dalam larutan (NH4Cl(aq)): Amonium klorida dapat larut dalam air membentuk larutan yang mengandung ion amonium (NH4+) dan ion klorida (Cl-). Larutan amonium klorida digunakan dalam berbagai aplikasi, seperti pengolahan air, elektrokimia, dan sintesis kimia.
- Amonium klorida sebagai obat batuk: Amonium klorida digunakan sebagai bahan dalam pembuatan obat batuk dan ekspektoran. Contohnya merupakan sirup batuk yang mengandung amonium klorida untuk membantu meredakan batuk dan melonggarkan dahak.
- Amonium klorida dalam baterai: Dalam beberapa jenis baterai, seperti baterai seng-karbon, amonium klorida digunakan sebagai elektrolit. Senyawa ini membantu dalam menghantarkan muatan listrik antara elektroda positif dan negatif dalam baterai.
- Amonium klorida dalam proses pemurnian logam: Dalam industri logam, amonium klorida digunakan dalam proses pemurnian logam. Senyawa ini membantu menghilangkan oksida logam yang tidak diinginkan dan membantu memperoleh logam yang lebih murni.
- Amonium klorida dalam pewarna tekstil: Dalam industri tekstil, amonium klorida digunakan sebagai agen mordan, yang membantu meningkatkan daya serap pewarna pada serat tekstil dan memperkuat ikatan warna.
- Amonium klorida dalam pengolahan air: Amonium klorida digunakan dalam pengolahan air untuk pengendapan partikel-padatan dan penghilangan kekeruhan dalam air.
Perlu dicatat bahwa ini hanya beberapa contoh penggunaan senyawa amonium klorida, dan senyawa ini mempunyai berbagai aplikasi di berbagai industri dan bidang.
Referensi
Berikut ini beberapa referensi buku yang dapat Anda gunakan untuk mempelajari lebih lanjut tentang senyawa amonium klorida:
- “Descriptive Inorganic Chemistry” oleh Geoff Rayner-Canham dan Tina Overton
- “Inorganic Chemistry” oleh Gary L. Miessler, Paul J. Fischer, dan Donald A. Tarr
- “Principles of Inorganic Chemistry” oleh Brian W. Pfennig dan Jason R. Fish
- “Chemistry: The Central Science” oleh Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten, Catherine Murphy, dan Patrick Woodward
Pastikan untuk memeriksa ketersediaan buku-buku ini di perpustakaan universitas, toko buku, maupun platform daring yang menyediakan akses ke buku teks.